编辑推荐:
相关研究成果以 “A Traceless Site-Specific Conjugation on Native Antibodies Enables Efficient One-Step Payload Assembly” 为题在线发表于学术期刊Angewandte Chemie International Edition上
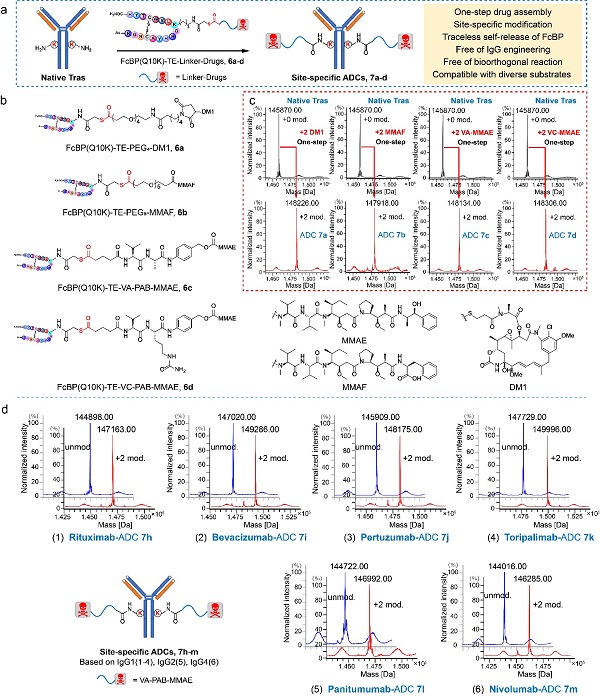
抗体药物偶联物(Antibody-Drug Conjugate,ADC)是将小分子细胞毒性药物共价偶联物到抗体上形成的复合物,利用抗体特异性达到小分子药物靶向递送,实现肿瘤的选择性杀伤。近年来研究发现,将小分子药物定量偶联到抗体的特定位点所形成定点ADC药物具有更好的治疗指数,逐渐成为ADC药物领域研发的重点。但由于抗体复杂的氨基酸组成,通过化学手段定点偶联小分子药物一直充满挑战。其中,配体导向的定点偶联技术是一种潜在的方法,但冗余的配体难以释放或复杂的释放过程限制了该技术在定点ADC药物研发中的应用。
为了解决上述问题,中国科学院上海药物所黄蔚课题组开发了基于硫酯结构的新颖配体导向酰化试剂,在定点修饰抗体特定位点赖氨酸的同时自动释放冗余的配体结构,首次通过化学手段实现定点抗体偶联药物(Antibody-Drug Conjugate,ADC)的“一步”、“无痕”制备策略,为定点ADC药物发展提供了新颖的制备方法。相关研究成果以 “A Traceless Site-Specific Conjugation on Native Antibodies Enables Efficient One-Step Payload Assembly” 为题在线发表于学术期刊Angewandte Chemie International Edition上。
研究团队利用该技术实现了天然抗体曲妥珠单抗的“一步”定点叠氮化、生物素化以及多种小分子药物等不同形式的功能性分子修饰,均特异性地偶联2分子化合物。高分辨质谱、质谱组学分析等分析手段均证明小分子修饰特异性地发生在抗体Fc区域的K248位(通用命名位点),具有极高的位点选择性。同时,该技术也同样适用于利妥昔单抗、帕妥珠单抗、贝伐单抗等IgG1抗体,帕尼单抗等IgG2抗体、纳武利尤单抗等IgG4抗体,具有很好的底物普适性。
随后,团队基于曲妥珠单抗制备了4种具有不同药物连接子的“一步法”定点ADC化合物,以及3种基于生物正交反应的“两步法”定点ADC化合物,并对其进行了初步的药学评价。所有的ADC化合物均具有很好的结构均一性(DAR=2)、很强的体外肿瘤细胞抑制活性(<0.1 nM)及极低的细胞毒性(≥1000 nM)。同时,相比随机偶联制备的阳性ADC化合物(DAR≈3.3),利用该技术获得的多个定点ADC化合物虽然具有更低的载药量(DAR=2),但显示出更强的体内肿瘤抑制活性。
综上所述,该研究团队通过设计新颖的酰化试剂及对配体结构的优化,实现了天然抗体特定位点赖氨酸的“一步”、“无痕”定点定量修饰。该技术首次通过化学手段实现了定点ADC化合物的高效、均一制备,无需进行抗体的工程化改造,不依赖生物正交反应,且兼容多样化的底物结构和抗体类型,为定点ADC药物研发提供了重要的技术方法。
上海药物所黄蔚研究员与唐峰副研究员为论文通讯作者,上海药物所博士研究生曾悦为论文第一作者。该论文还得到了来自上海药物所周虎研究员、黄河研究员、刁星星研究员在小分子修饰位点鉴定方面的大力支持和帮助。该工作得到国家自然科学基金、中科院特别研究助理项目、上海市扬帆计划、上海市科技重大项目、杭州创新创业领导团队项目及临港实验室的基金支持。
图1. 新技术“一步”实现天然抗体的多样化细胞毒分子修饰
图2. 基于该技术的定点ADC药物体内外活性评价数据
(供稿部门:黄蔚课题组;供稿人:曾悦)