
-

生物通官微
陪你抓住生命科技
跳动的脉搏
BIOPIC汤富酬课题组与合作者利用单细胞双组学技术揭示嵌合胚胎试管婴儿体内非整倍体细胞清除机制
【字体: 大 中 小 】 时间:2022年08月20日 来源:北京大学新闻网
编辑推荐:
课题组在 Genomics, Proteomics & Bioinformatics杂志发表论文,该研究首次在单细胞分辨率,从多组学的角度对来自嵌合胚胎的试管婴儿进行了深入评估,表明这些嵌合胚胎常常也可以成功发育成健康婴儿,胚胎期染色体嵌合问题得到了完全纠正。这为滋养外胚层活检诊断出的嵌合胚胎提供了新的见解。

近年来,随着高通量测序技术应用于体外受精胚胎的植入前遗传学诊断,有关胚胎嵌合现象的报道越来越多。研究表明,人类着床前胚胎的嵌合比例很高,滋养外胚层(TE)活检的嵌合诊断率从3%到26%不等[1]。胚胎嵌合是指同一个胚胎中既有正常的二倍体细胞、也有异常的非整倍体细胞的现象。这通常是在胚胎发育早期,部分胚胎细胞在有丝分裂过程中发生染色体分离错误导致的。
体外受精胚胎中,部分细胞发生染色体异常对胚胎发育潜力的影响还不完全清楚。据报道,嵌合胚胎在植入后,可能植入失败,或者植入后发生流产,也可能发育至活产,甚至诞生正常婴儿。嵌合胚胎移植回孕妇体内后的妊娠率和活产率从16%到47%不等[1-3]。了解胚胎嵌合的后果对于体外受精胚胎和自然受精胚胎都很重要,但目前对移植的嵌合胚胎的产后评估是不够的。目前的评估主要集中在妊娠率和出生率上,而单细胞分辨率的产后染色体检测数据仍然缺乏。最近Capalbo等人[4]进行了一项前瞻性研究,他们发现滋养外胚层活检时判断为嵌合的胚胎与判断为正常整倍体的胚胎具有相似的发育潜力。他们对部分嵌合胚胎移植出生的新生儿,采集其唾液样本,使用单核苷酸多态性阵列(SNP array)技术进行大量细胞混合样品分析,确认新生儿在外胚层衍生的细胞谱系中没有高比例的核型异常。

2022年8月6日,北京大学生物医学前沿创新中心(BIOPIC)汤富酬课题组与中国人民解放军总医院姚元庆课题组合作在 Genomics, Proteomics & Bioinformatics 杂志发表题为“Single-cell sequencing reveals clearance of blastula chromosomal mosaicism inIn Vitro fertilization babies”的研究论文。该研究对7名嵌合囊胚移植后出生的试管婴儿进行了后续的追踪,采集他们的外周血单核细胞进行了单细胞双组学测序,对单个细胞的类型和染色体拷贝数进行了精准检测,在单细胞分辨率下探索嵌合胚胎移植后出生的试管婴儿外周血单核细胞的染色体拷贝数状态,评估了这些健康出生的婴儿体内是否还存在与胚胎早期相同的染色体拷贝数异常(CNA),以及是否出现了新的染色体拷贝数异常(图1)。该研究发现:
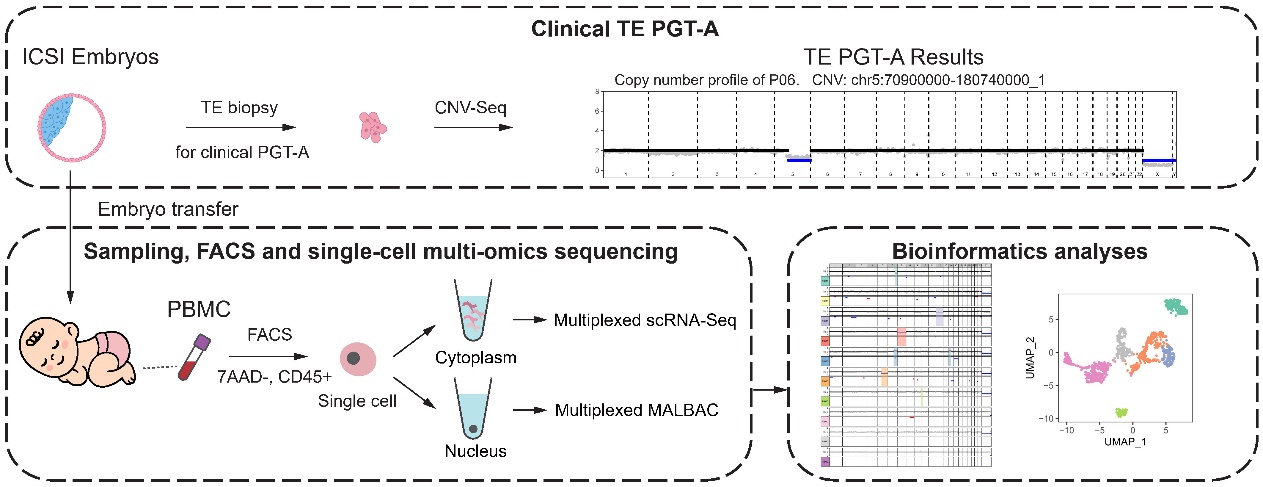
图1. 研究示意图
来自嵌合胚胎的试管婴儿外周血单核细胞中已经检测不到胚胎早期发生的染色体拷贝数异常。该研究对7名来自嵌合胚胎的试管婴儿、以及3名来自正常整倍体胚胎的试管婴儿(作为对照)的总共1616个细胞进行了单细胞双组学测序,每个婴儿平均测序了100-300个单细胞。该研究重点关注了嵌合胚胎在滋养外胚层活检时发生拷贝数异常的染色体区域。结果表明,这些试管婴儿的外周血单核细胞在这些对应的染色体区域的拷贝数都正常(图2)。一个似乎是例外的情况来自5号病例的一个外周血单核细胞,它在基因组检测中显示在滋养外胚层活检异常的染色体区域有拷贝数缺失。然而,其缺失的染色体区域长度比滋养外胚层活检时异常的染色体区域短得多,且拷贝数变化与在滋养外胚层活检的拷贝数变化方向相反(滋养外胚层活检时是6号染色体长臂一个大片段的拷贝数增加,而在试管婴儿外周血单核细胞检测时是6号染色体长臂一个小片段的拷贝数减少)。因此该研究发现,来自嵌合胚胎的试管婴儿外周血单核细胞中已经检测不到胚胎早期发生的染色体拷贝数异常(图2)。

图2. 囊胚期滋养外胚层活检结果和试管婴儿的外周血单核细胞的染色体拷贝数异常对比图
来自嵌合胚胎的试管婴儿外周血单核细胞中一小部分细胞发生了其他染色体区域的拷贝数异常。来自嵌合胚胎的试管婴儿和来自整倍体胚胎的对照组试管婴儿的外周血单核细胞中,一部分细胞仍然发生了染色体拷贝数异常(拷贝数异常的染色体区域长度在10Mb以上的),平均发生频率为1.2%(从0%到2.5%)(图3)。这些外周血单核细胞中发生异常的染色体区域表现出相对随机的模式。与此同时,对应的单细胞转录组信息也显示这些染色体拷贝数异常的细胞,存在于外周血单核细胞的各种细胞类型中(图3)。最近黄岩谊实验室和王建斌实验室报道了在健康人群的外周血单核细胞中普遍存在染色体拷贝数异常,染色体拷贝数异常细胞在外周血单核细胞中的比例在7.5%左右[5]。与成年人相比,这些1-3岁婴儿的染色体拷贝数异常细胞的比例似乎略低。
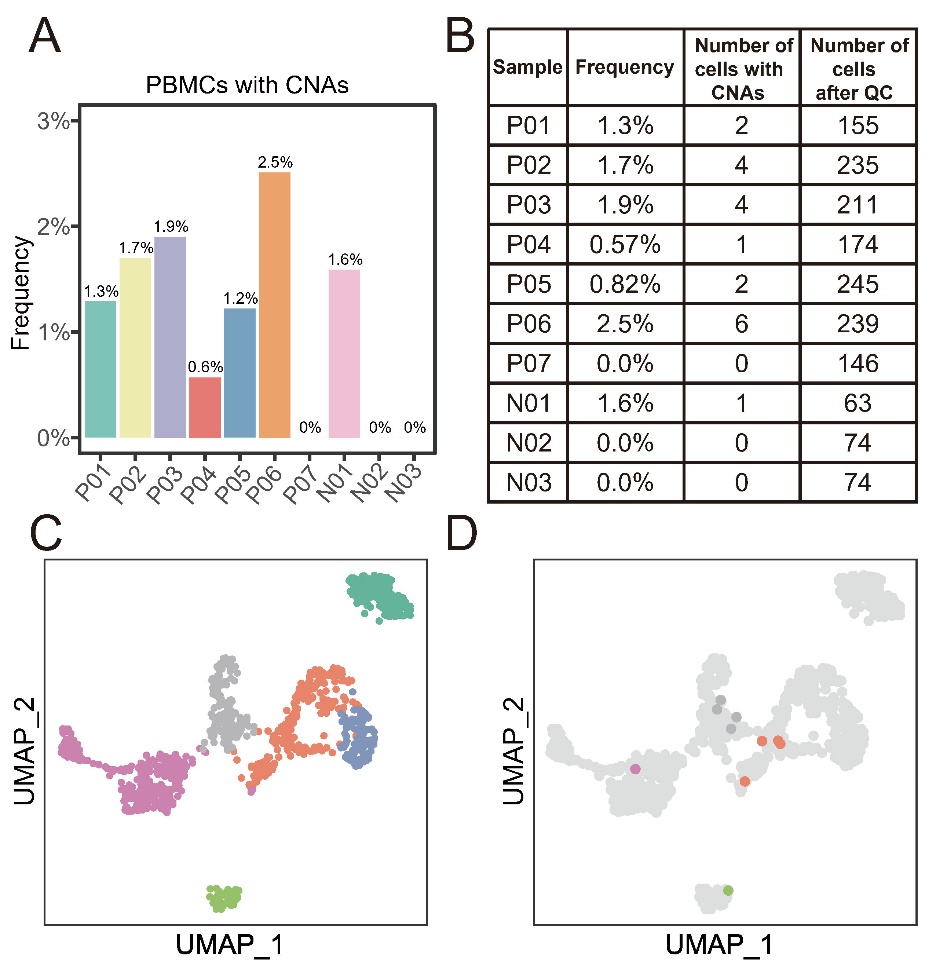
图3. 试管婴儿外周血单核细胞中染色体拷贝数异常细胞的比例及分布
以上结果表明,试管婴儿的胚胎染色体嵌合问题通过某些细胞机制得到了纠正。这可能是通过以下两个途径:异常的非整倍体胚胎细胞相比于正常整倍体细胞分裂增殖更缓慢,或者异常的非整倍体胚胎细胞更容易发生凋亡,最终在嵌合胚胎中,异常的非整倍体细胞被选择性消除了。研究表明,小鼠囊胚内细胞团谱系的非整倍体细胞会通过凋亡被选择性消除,非整倍体细胞比例从囊胚期开始逐渐减少[6]。另一项研究表明,早期胚胎中整倍体和非整倍体细胞的增殖和死亡动力学是不同的,非整倍体细胞增殖较慢并且容易发生凋亡,而整倍体细胞增殖快并且很少发生凋亡[7]。这些问题非常值得未来更深入的探索。
综上所述,该研究首次在单细胞分辨率,从多组学的角度对来自嵌合胚胎的试管婴儿进行了深入评估,表明这些嵌合胚胎常常也可以成功发育成健康婴儿,胚胎期染色体嵌合问题得到了完全纠正。这为滋养外胚层活检诊断出的嵌合胚胎提供了新的见解。在没有正常整倍体胚胎可用的情况下,可以考虑移植嵌合胚胎。这为卵巢储备较差、促排卵后胚胎数量有限或仅有嵌合胚胎和染色体全部异常的胚胎的患者提供了新的希望。
北京大学前沿交叉学科研究院博士生高原、中国人民解放军总医院博士生张晋宁、北京大学生命科学学院博士生刘振宇、博士生祁淑悦为该论文的并列第一作者。北京大学生物医学前沿创新中心汤富酬教授和中国人民解放军总医院姚元庆教授为共同通讯作者。该研究项目得到了国家自然科学基金委、“十三五”国家重点研发计划“生殖健康及重大出生缺陷防控研究”专项《胚胎植入前遗传学诊断新技术研发及规范化研究》、北大-清华生命科学联合中心和北京未来基因诊断高精尖创新中心的支持。
参考文献
[1] Practice C, Genetic Counseling Professional Group of the American Society for Reproductive Medicine. Electronic address aao. Clinical management of mosaic results from preimplantation genetic testing for aneuploidy (PGT-A) of blastocysts: a committee opinion. Fertil Steril 2020;114:246-54.
[2] Greco E, Minasi MG, Fiorentino F. Healthy Babies after Intrauterine Transfer of Mosaic Aneuploid Blastocysts. N Engl J Med 2015;373:2089-90.
[3] Victor AR, Tyndall JC, Brake AJ, Lepkowsky LT, Murphy AE, Griffin DK, et al. One hundred mosaic embryos transferred prospectively in a single clinic: exploring when and why they result in healthy pregnancies. Fertil Steril 2019;111:280-93.
[4] Capalbo A, Poli M, Rienzi L, Girardi L, Patassini C, Fabiani M, et al. Mosaic human preimplantation embryos and their developmental potential in a prospective, non-selection clinical trial. Am J Hum Genet 2021;108:2238-47.
[5] Liu L, Chen H, Sun C, Zhang JY, Wang JC, Du MJ, et al. Low-frequency somatic copy number alterations in normal human lymphocytes revealed by large-scale single-cell whole-genome profiling. Genome Research 2022;32:44-54.
[6] Bolton H, Graham SJL, Van der Aa N, Kumar P, Theunis K, Fernandez Gallardo E, et al. Mouse model of chromosome mosaicism reveals lineage-specific depletion of aneuploid cells and normal developmental potential. Nat Commun 2016;7:11165.
[7] Liu YL, Yu TN, Wang PH, Tzeng CR, Chen CH, Chen CH. Could PGT-A pick up true abnormalities that have clinical relevance? Retrospective analysis of 1043 embryos. Taiwan J Obstet Gynecol 2020;59:496-501.
下载安捷伦电子书《通过细胞代谢揭示新的药物靶点》探索如何通过代谢分析促进您的药物发现研究
10x Genomics新品Visium HD 开启单细胞分辨率的全转录组空间分析!
 生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
