
-

生物通官微
陪你抓住生命科技
跳动的脉搏
张亮教授课题组揭示核转运蛋白Hikeshi及其靶蛋白HSP70在髓鞘形成中的功能和作用机制
【字体: 大 中 小 】 时间:2023年10月25日 来源:厦门大学生命科学学院
编辑推荐:
2023年10月20日,细胞应激生物学国家重点实验室、厦门大学生命科学学院、厦门大学附属妇女儿童医院的张亮教授课题组在Developmental Cell上发表了题为Nuclear Import Carrier Hikeshi Cooperates with HSP70 to Promote Murine Oligodendrocyte Differentiation and CNS Myelination的论文,揭示Hikeshi在少突胶质细胞分化和髓鞘生成中的功能和作用机制
脑白质病变(Leukodystrophy)是一种常见的神经系统疾病, 主要病理表现为脑白质完整性破坏或脱髓鞘病变, 临床上可表现为认知障碍、运动障碍、共济失调及神经元损害的不同组合,常见于脑卒中、阿尔茨海默症、帕金森病、多发性硬化症、精神分裂症等多种疾病中。目前,对脑白质病变的致病因素和发病机制的认识尚不清楚。
在细胞经受热应激时,经典核转运蛋白Importin家族成员功能受到抑制,Hikeshi作为入核转运蛋白介导热休克蛋白HSP70s (HSP70和HSC70) 的大量入核。目前有病例报道,Hikeshi的错义突变,p.Cys4Ser及p.Val54Leu,使病人患有脑白质营养不良,表现出下肢痉挛、视神经萎缩、髓鞘发育迟缓等临床特征。但目前对于Hikeshi 及其突变形式在该遗传性脑白质病变中的功能和致病机理尚不清楚。
2023年10月20日,细胞应激生物学国家重点实验室、厦门大学生命科学学院、厦门大学附属妇女儿童医院的张亮教授课题组在Developmental Cell上发表了题为Nuclear Import Carrier Hikeshi Cooperates with HSP70 to Promote Murine Oligodendrocyte Differentiation and CNS Myelination的论文,揭示Hikeshi在少突胶质细胞分化和髓鞘生成中的功能和作用机制。
研究人员发现Hikeshi的遗传突变导致蛋白降解,进而构建了少突细胞谱系特异性敲除的小鼠,发现Hikeshi的缺失会抑制少突细胞分化和髓鞘生成。在少突胶质细胞分化过程中伴随着HSP70s的入核,而Hikeshi的缺失会影响少突胶质细胞中HSP70s的入核转运。HSP70s可以正向调控少突胶质细胞的分化,同时在脱髓鞘损伤模型中也验证HSP70s对于髓鞘再生的重要作用。机制研究发现,E3泛素连接酶FBXW7可以与少突胶质细胞的重要转录因子SOX10结合并介导其泛素化降解,而细胞核内的HSP70s能够减弱FBXW7与SOX10之间的相互作用,维持了SOX10的稳态。
考虑到HSP70s同时作为热休克蛋白发挥功能,研究人员采用对小鼠无害并且能导致HSP70s入核的轻度热疗,发现热疗对于少突胶质细胞的分化和髓鞘生成具有促进作用,并且能够有效的缓解缺氧和溶血磷脂酰胆碱(LPC)局部注射所造成的髓鞘损伤。
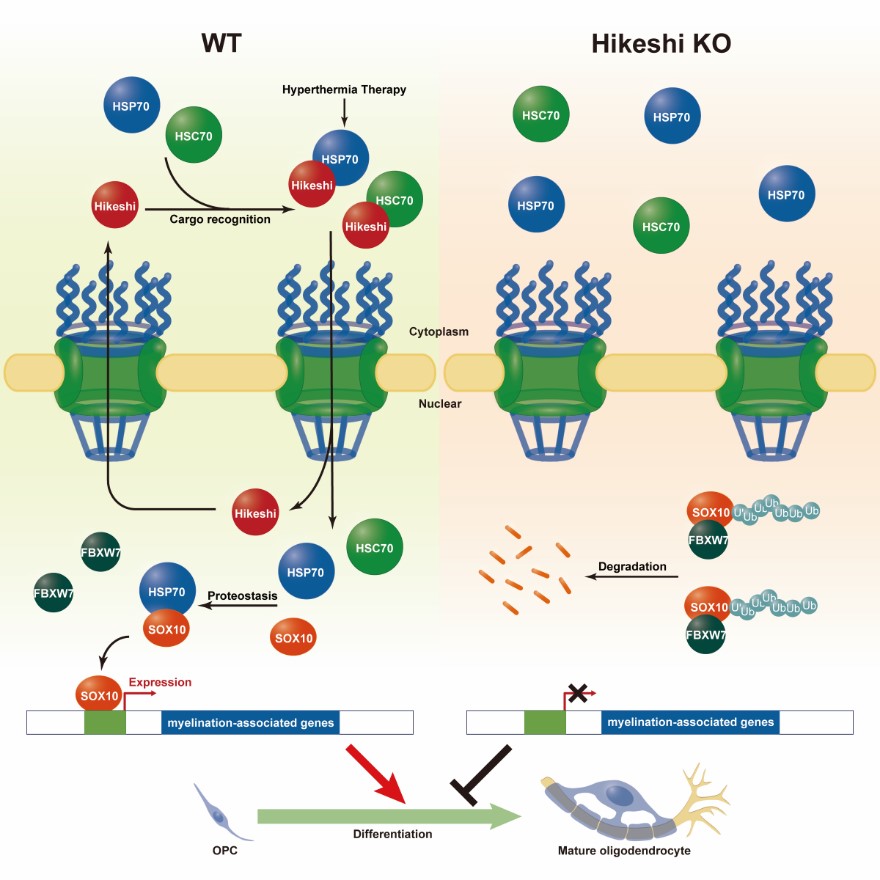
综上,该项研究揭示了核转运蛋白Hikeshi-HSP70s在中枢神经系统中的生理功能和作用机制,以及热疗可作为缓解髓鞘损伤的有效方法,为脱髓鞘相关疾病的研究和防治提供了新的思路。
厦门大学生命科学学院博士生李荔、李道朋、孙狄与厦门大学附属妇女儿童医院张雪芹为共同第一作者,通讯作者为张亮教授。
文章链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00489-6
(图/文 张亮课题组)